مبانی شیمی پلیمر
مبانی شیمی پلیمر (رشته شیمی)
انتشارات پیام نور
مترجم: سید احمد میرشکرایی
برای دانلود این مجموعه مبانی شیمی پلیمر می توانید آن را در قالب پاورپوینت دانلود کنید
این مطلب در تاریخ: یک شنبه 24 فروردين 1393 ساعت: 2:39 منتشر شده است
 اميرحسين - واقعا دستتان درد نكند - 1392/2/17
اميرحسين - واقعا دستتان درد نكند - 1392/2/17
 قنبرآبادی - سلام.ممنون فقط لطفا اگه برنامه مقاله را هم داریدلطف کنید.مرسی - 1392/1/9
قنبرآبادی - سلام.ممنون فقط لطفا اگه برنامه مقاله را هم داریدلطف کنید.مرسی - 1392/1/9
 لولو - http://loxblog.ir/images/smilies/smile%20(10).gifhttp://loxb log.ir/images/smilies/smilhthttp://loxblog.ir/images/smiliht tp://loxblog.ir/images/smilieshttp://loxblog.ir/images/smili es/smile%20(26).gif/smile%20(30).gifes/smile%20(3)http://loh ttp://loxblog.ir/images/smilies/smile%20(27).gifxblog.ir/ima ges/smilies/smile%20(14).gif.giftp://loxblog.ir/images/smili eshttp://loxblog.ir/imhttp://loxblog.ir/images/smilies/smile %20(30).gifages/smilies/smile%20(12).gif/smile%20(5).gife%20 (10).gifhttp://loxblog.ir/images/smilies/smile%20(29).gif - 1392/1/5
لولو - http://loxblog.ir/images/smilies/smile%20(10).gifhttp://loxb log.ir/images/smilies/smilhthttp://loxblog.ir/images/smiliht tp://loxblog.ir/images/smilieshttp://loxblog.ir/images/smili es/smile%20(26).gif/smile%20(30).gifes/smile%20(3)http://loh ttp://loxblog.ir/images/smilies/smile%20(27).gifxblog.ir/ima ges/smilies/smile%20(14).gif.giftp://loxblog.ir/images/smili eshttp://loxblog.ir/imhttp://loxblog.ir/images/smilies/smile %20(30).gifages/smilies/smile%20(12).gif/smile%20(5).gife%20 (10).gifhttp://loxblog.ir/images/smilies/smile%20(29).gif - 1392/1/5
 سارا - سلام این ازمایشهای جالب را از کجا اوردین
سارا - سلام این ازمایشهای جالب را از کجا اوردین فلاحتکار - سلام
فلاحتکار - سلام  SARA - مرسی مطلب خوب ومفیدی بود... - 1391/10/19
SARA - مرسی مطلب خوب ومفیدی بود... - 1391/10/19
 7887 - لطفا آزمایش های جالب برای دوم راهنمایی باشند ولی نه آزمایش های گتاب - 1391/10/13
7887 - لطفا آزمایش های جالب برای دوم راهنمایی باشند ولی نه آزمایش های گتاب - 1391/10/13
مبانی شیمی پلیمر (رشته شیمی)
انتشارات پیام نور
مترجم: سید احمد میرشکرایی
برای دانلود این مجموعه مبانی شیمی پلیمر می توانید آن را در قالب پاورپوینت دانلود کنید
سایت شیمی کاربردی برای شما دانشجویان و محققین گرانقدر فایل های پاورپوینت آزمایشگاه شیمی آلی 2(کامل به همراه عکس) و کتاب مکانیسم و تئوری در شیمی آلی نوشته ی لری را آماده کرده است.دانلود کنید و لذت ببرید.
دانلود آزمایشگاه شیمی آلی 2 رمز:www.analyte.ir
دانلود کتاب مکانیسم و تئوری در شیمی آلی رمز: alivechem.com

از تر کیبات کروم از جمله اکسید کروم سبز , زرد کروم و نارنجی کروم در صنایع رنگ سازی استفاده می شود. این رنگدانه ها در رنگها و پلاستیکها کاربرد دارند. از جمله ویژگی های رنگدانه های کرومات سرب درخشندگی فام ، قدرت رنگ زنندگی و قدرت پوشانندگی بالا را می توان نام برد.
روش تهیه زرد کروم ( PbCrO4 ) :
6.5 گرم استات سرب را وزن کرده در ۵۰ میلی لیتر اب مقطر حل کنید سپس ۱٫۵ گرم دی کرومات پتاسیم را با ان مخلوط نمایید. محصول را به مدت نیم ساعت در درجه حرارت ۸۵ تا ۹۰ درجه سانتیگراد در حمام اب قرار دهید. سپس ان را سرد و بعد صاف نمایید و رسوب بدست امده را در اتوکلاو در ۱۰۰ درجه سانتیگراد خشک کنید.
روش تهیه نارنجی کروم ( PbCrO4.PbO ):
6.5 گرم استات سرب را در ۶۰ میلی لیتر اب مقطر حل کنید. ۱٫۵ گرم دی کرومات پتاسیم به محلول استات سرب اضافه کنید در هنگام جوشیدن ۱۹ میلی لیتر محلول سود ۴ نرمال به ان اضافه کنید. سپس محصول را به مدت ۲۰ دقیقه در درجه حرارت ۹۰ درجه سانتیگراد قرار داده و سپس ان را صاف کرده و خشک کنید.
از اولین کامپوزیتها یا همان چندسازههای ساخت بشر میتوان به کاه گل اشاره کرد. قایقهایی که سرخپوستها با قیر و بامبو میساختند و تنورهایی که از گل ، پودر شیشه و پشم بز ساخته میشدند و در نواحی مختلف کشورمان یافت شده است، از کامپوزیتهای نخستین هستند. بسیاری از نیازهای صنعتی صنایعی مانند صنایع فضایی ، راکتورسازی ، الکترونیکی و غیره نمیتواند با استفاده از مواد معمولی شناخته شده ، برآورده شود. اما قسمتی از آن نیازها ، میتواند با استفاده از چندسازهها یا کامپوزیتها برآورده گردد. چندسازهها به موادی گفته میشود که از مخلوطی از دو یا چند عنصر ساخته شده باشند.
در حالیکه در چندسازهها ، نه فقط خواص هر یک از اجزاء آن برجا باقی میماند، بلکه در نتیجه پیوستن آنها با یکدیگر ، خواص جدیدتر و بهتر هم بدست میآید. مواد مختلط همیشه ناهمگن میباشد. بررسیها و تحقیقات برای دست یافتن به مواد جدیدتر با خواص مکانیکی بهتر ، همواره انجام میگرفته و هنوز هم همگام با پیشرفت صنایع دنبال میگردد. در این بررسیها ، اغلب این هدف دنبال میشود که به موادی با نسبت مناسب از استحکام کششی به چگالی ، استحکام حرارتی بالا و خواص ویژه سطح خارجی دست یابند.
بسیاری از واکنش های شیمیایی در محلول های آبی انجام می شود، یعنی محلولی که آب در آن به عنوان حلال است
غلظت مولی: تعداد مول های حل شده در یک لیتر از محلول است و واحد آن mol/l است که معمولاً به آن مولاریته می گویند. مولاریته را با M نشان میدهند. برای نمایش غلظت محلول HCl 0.01 مولار می نویسند [HCl]=0.01M
M = n ÷ V
M = غلظت محلول بر حسب mol/L,
n = مول های حل شونده
V = حجم محلول بر حسب (L)
نوآرایی فرمول بله صورت های
n = M x V
-الكترودهای فلزی: یک الکترود فلزی است که در داخل محلول قرار دارد مانند نقره، آهن، پلاتین
- الكترود نوع اول بیاثر: عمدتاً از یك فلز تأثیرناپذیر یا واكنشناپذیر مانندAu , Pt تشكیل میشود كه در محلول یك سیستم Red oxوارد میگردد.
الكترود نوع اول واكنشپذیر: الكترود فلزی واكنشپذیر كه در داخل محلول یونهای همان الکترود قرار دارد
دلایل عدم کاربرد اکثر فلزات بعنوان الكترود فلزی واكنشپذیر
به علت وجود اكسید بر سطح آنها و یا سایر عوامل جوابهای تكرار پذیر نمی دهند مانند فلزاتی نظیر آهن
اگر شیب E = f(-logMn+) برابر با(0.0591/n) باشد الكترود برای اندازهگیری -log Mn+یاpMn+ مناسب است.
ـ الكترود نوع دوم: كلیه الكترودهای واكنشپذیر كه در مجاورت تركیب كم محلول و یا كمپلكس خود بوده و در محلول آنیون تركیب قرار داشته باشند. مثل الكترود كالومل، نقره ـ نقره كلرید و...
Ag |AgCl↓, Cl-(x M) Hg |Hg2Cl2↓, Cl-(x M)
الكترود نوع دوم میتواند برای تعیین غلظت آنیون بكار رود.
پدیده تبادل یون برای اولین بار در سال 1850 و به دنبال مشاهده توانایی خاکهای زراعی در تعویض برخی از یونها مثل آمونیوم با یون کلسیم و منیزم موجود در ساختمان آنها گزارش شد. در سال 1870 با انجام آزمایشهای متعددی ثابت شد که بعضی از کانیهای طبیعی بخصوص زئولیتها واجد توانایی انجام تبادل یون هستند. در واقع به رزینهای معدنی ، زئولیت میگویند و این مواد یونهای سختی آور آب (کلسیم و منیزیم) را حذف میکردند و به جای آن یون سدیم آزاد میکردند از اینرو به زئولیتهای سدیمی مشهور شدند که استفاده از آن در تصفیه آب مزایای زیاد داشت چون احتیاج به مواد شیمیایی نبود و اثرات جانبی هم نداشتند.
اما زئولیتهای سدیمی دارای محدودیتهایی بودند. این زئولیتها میتوانستند فقط سدیم را جایگزین کلسیم و منیزیم محلول در آب نمایند و آنیونهایی از قبیل سولفات ، کلراید و سیلیکاتها بدون تغییر باقی میمانند. واضح است چنین آبی برای صنایع مطلوب نیست. پس از انجام تحقیقات در اواسط دهه 1930 در هلند زئولیتهایی ساخته شد که به جای سدیم فعال ، هیدروژن فعال داشتند. این زئولیتها که به تعویض کنندههای کاتیونی هیدروژنی معروف جدید ، سیلیس نداشته و علاوه بر این قادرند همزامان هم سختی آب را حذف کنند و هم قلیائیست آب را کاهش دهند.
برای بهبود تکنولوژی تصفیه آب ، گامهای اساسی در سال 1944 برداشته شد که باعث تولید زرینهای تعویض آنیونی شد. زرینهای کاتیونی هیدروژنی تمام کاتیونی آب را حذف میکنند و رزینهای آنیونی تمام آنیونهای آب را از جمله سیلیس را حذف مینمایند ، در نتیجه میتوان با استفاده از هر دو نوع زرین ، آب بدون یون تولید کرد. همچنین پژوهشگران دریافتند که سیلیکات آلومینیم موجود در خاک قادر به تعویض یونی میباشد. این نتیجه گیری با تهیه ژل سیلیکات آلومینیم از ترکیب محلول سولفات آلومینیم و سیلیکات سدیم به اثبات رسید. بنابراین اولین رزین مصنوعی که ساخته شد سیلیکات آلومینیم بود. و امروزه اکثر زرینهای تعویض یونی که در تصفیه آب بکار میروند رزینهای سنتزی هستند که با پلیمریزاسیون ترکیبات آلی حاصل شدهاند.
رزینهای موازنه کننده یون ، ذرات جامدی هستند که میتوانند یونهای نامطلوب در محلول را با همان مقدار اکی والان از یون مطلوب با بار الکتریکی مشابه جایگزین کنند. رزینهای تعویض یونی شامل بار مثبت کاتیونی و بار منفی آنیونی میباشد بگونهای که از نظر الکتریکی خنثی هستند. موازنه کنندهها با محلولهای الکترولیت این تفاوت را دارند که فقط یکی از دو یون ، متحرک و قابل تعویض است به عنوان مثال ، یک تعویض کننده کاتیونی سولفونیک دارای نقاط آنیونی غیر متحرکی است که شامل رادیکالهای آنیونی SO2-3 میباشد که کاتیون متحرکی مثل +H یا +Na به آن هستند.
غالب دستگاه ها و روش های رایج جهت تصفیه و آهک زدائی آب در مقیاس صنعتی وحجم زیاد صحیح عمل می کنند اما در مورد تصفیه آب در مقیاس کم به دلایل زیر دچار اشکال بوده و در برخی از موارد یا درست عمل نمی کنند و یا حتی مواد مضر وارد آب می کنند.
این دستگاه ها یا از فیلتر ساده سرامیک و غیرو و یا از فیلترهای حاوی ذغال اکتیو و رزین های تعویض یون (Ion exchange) در بسته های پلاستیکی و یا از فیلتری که به اسموز معکوس و یا فیلتر ملکولی (Revers osmos or Molekular filter) معروف است استفاده می کنند.
فیلترهای سرامیک تنها و تنها قادر به جدا کردن مواد شناور در آب هستند.
یکی از رایج ترین این دستگاه ها ظرف پلاستیکی ای است که در آن یک فیلتر حاوی مخلوطی از ذغال اکتیو و رزین تعویض یون قرار گرفته و آب با گذر از آن، از قرار تصفیه می شود؛ این فیلتر هرچند یکبار می بایست تعویض شود.
کربن فعال بهعنوان یک جاذب دارای کاربردهای مهم و حیاتی میباشد. این ماده از پیرولیز موادگیاهی حاوی کربن تولید میشود و تحت عملیات فعالسازی قرار میگیرد.
با توجه به نوع موادخام مصرفی، کربنهای فعال دارای اندازه منفذ و شکلهای متفاوت هستند و از طرفی با توجه به اندازه منفذ و توزیع اندازه دارای کاربردهای گسترده و ویژهای میباشند. در این مقاله مراحل تولید کربن فعال و ساختار منفذی انواع کربن فعال مورد بررسی قرار میگیرد.
کربن فعال به گروهی از مواد اطلاق میشود که مساحت سطح داخلی بالا، تخلخل و قابلیت جذب گازها و مایعات شیمیائی را دارند. کربنهای فعال بهعنوان جاذبهای حیاتی در صنایع شناخته شدهاند و کاربردهای گستردهای با توجه به قابلیت جذب گازها و مایعات مزاحم دارند و میتوان از آنها برای تصفیه و پاکسازی و حتی بازیافت موادشیمیائی استفاده نمود. کربنهای فعال بهدلیل ویژگیهای منحصربهفرد و همچنین قیمت پائین در مقایسه با جاذبهای غیرآلی مانند زئولیت از اهمیت ویژهای برخوردار میباشند. کربنهای فعال شده بهدلیل مساحت گسترده آنها، ساختار منفذی، ظرفیت جذب بالا و قابلیت فعالسازی مجدد سطح، یک ماده منحصربهفرد میباشند. کاربرد مهم و قابل اهمیت آنها در جداسازی بو، رنگ، مزههای غیردلخواه از آب در عملیاتهای خانگی و صنعتی، بازیافت حلال، تصفیه هوا بهویژه در رستورانها، صنایع غذائی و شیمیائی میباشد، همچنین با موادغیرآلی بهعنوان کاتالیست نیز استفاده میشوند. در داروسازی نیز برای مبارزه با یک نوع باکتری خاص مورد استفاده قرار میگیرند و بهعنوان جداکننده اسیدهای آروماتیک از حلال در داخل اسیداستیک نیز میتوان از کربن فعال استفاده کرد.کربنهای فعالشده محصولات پیچیدهای میباشند و به تبع طبقهبندی براساس رفتار، مشخصات سطح و روش آمادهسازی آنها مشکل میباشد، هر چند یکسری طبقهبندی براساس مشخصات فیزیکی آنها انجام شده است.
۱. کربن فعال پودری (دارای اندازهای کمتر از ۱۰۰ نامومتو و میانگین قطری بین ۱۵ تا ۲۵ میکرومتر)
۲. کربن فعال گرانولی (دارای اندازهای بزرگتر از کربن فعال شده پودری میباشد)
۳. کربن فعال کروی
۴. کربن تزریق شده
۵. کربن روکش شده با پلیمرها
استاندارد جذب برای کربن فعال مورد استفاده این است که بتواند تا حدود ۲۰% وزنی گاز GB و یا سیانوژن کلراید جذب نماید. اگر کربن فعال تازه باشد و در معرض رطوبت قرار نگرفته باشد خواهد توانست تا ۴۰% وزنی GB جذب نماید. تعداد زیادی از گازهای سمی را میتوان با گذراندن از کربن فعال شده از هوا جدا کرد، این خاصیت برای مواد شیمیائی با وزن مولکولی بالا از قبیل مواد شیمیائی GB مؤثر میباشد، گازهای سبک از قبیل کربن یا سیانوژن کلراید را نمیتوان بهراحتی سایر گازها جدا نمود، منواکسید کربن یکی از موادی است که به سختی میتوان به کمک کربن فعال جذب نمود ولی میتوان با استفاده از تزریق یکسری از موادشیمیائی به کربن فعال، قابلیت جذب اینگونه مواد را در کربن فعال ایجاد نمود و قدرت بازدارندگی کربن فعال را بالا برد. موادیکه بدین منظور میتوان استفاده نمود نمکهای نقره، مس و کرم میباشد.
● مراحل تولید
کربن فعال شده از پیرولیز موادکربنی از قبیل چوب، زغالسنگ و هسته میوهها یا پلیمرهای مصنوعی از قبیل ریون، پلیاکریلونیتریل یا فنولیک حاصل میگردد و در مراحل بعدی تحت عملیات فعالسازی قرار میگیرد. پیرولیز موادکربنی، بدون حضور هوا، باعث تخریب مولکولهای غیرآلی میشود که یک ماده قیری شکل حاوی موادگازدار خواهد بود و در نهایت یک جسم جامد کربنی از آن ایجاد خواهد شد. جسم تولیدشده دارای تعداد زیادی حفرههای بزرگ و دارای سطح ویژهای در حد چندین مترمربع برگرم میباشد.
 از تر کیبات کروم از جمله اکسید کروم سبز , زرد کروم و نارنجی کروم در صنایع رنگ سازی استفاده می شود. این رنگدانه ها در رنگها و پلاستیکها کاربرد دارند. از جمله ویژگی های رنگدانه های کرومات سرب درخشندگی فام ، قدرت رنگ زنندگی و قدرت پوشانندگی بالا را می توان نام برد.
از تر کیبات کروم از جمله اکسید کروم سبز , زرد کروم و نارنجی کروم در صنایع رنگ سازی استفاده می شود. این رنگدانه ها در رنگها و پلاستیکها کاربرد دارند. از جمله ویژگی های رنگدانه های کرومات سرب درخشندگی فام ، قدرت رنگ زنندگی و قدرت پوشانندگی بالا را می توان نام برد.
روش تهیه زرد کروم ( PbCrO4 ) :
6.5 گرم استات سرب را وزن کرده در ۵۰ میلی لیتر اب مقطر حل کنید سپس ۱٫۵ گرم دی کرومات پتاسیم را با ان مخلوط نمایید. محصول را به مدت نیم ساعت در درجه حرارت ۸۵ تا ۹۰ درجه سانتیگراد در حمام اب قرار دهید. سپس ان را سرد و بعد صاف نمایید و رسوب بدست امده را در اتوکلاو در ۱۰۰ درجه سانتیگراد خشک کنید.
روش تهیه نارنجی کروم ( PbCrO4.PbO ):
6.5 گرم استات سرب را در ۶۰ میلی لیتر اب مقطر حل کنید. ۱٫۵ گرم دی کرومات پتاسیم به محلول استات سرب اضافه کنید در هنگام جوشیدن ۱۹ میلی لیتر محلول سود ۴ نرمال به ان اضافه کنید. سپس محصول را به مدت ۲۰ دقیقه در درجه حرارت ۹۰ درجه سانتیگراد قرار داده و سپس ان را صاف کرده و خشک کنید.
اتیلن
اتیلن کوچکترین عضو خانوده آلکنها و به فرمول C2H4 میباشد که دو اتم هیدروژن کمتر از آلکان همکربن (اتان) دارد. ما در اینجا به بررسی ساختمان اتیلن میپردازیم تا با ساختار ترکیبات اشباع نشده آشنا شویم. بررسی ساختمان اتیلن به طریق کوانتوم مکانیکی نشان داده است که کربن ، برای اینکه در ساختمان اتیلن شرکت نماید، لازم است که با استفاده از اوربیتالهای 2s و دو اوربیتال 2p خود ، سه اوربیتال هیبریدی یکسان بوجود آورد که این اوربیتالهای هیبریدی ، در یک سطح قرار میگیرند، بنحوی که اتم کربن ، در مرکز یک مثلث قرار گرفته و زوایای بین اوربیتالهای هیبریدی ، 120 درجه تخمین زده شده است.
هرگاه ما چهار اتم هیدروژن و دو اتم کربن sp2 را کنار هم مرتب کنیم، شکلی ایجاد میشود که در آن ، هر اتم کربن در سه پیوند σ (سیگما) شرکت دارد. برای رسیدن به کربن به حالت اکتت ، لازم است که سومین اوربیتال 2p اتمهای کربن همپوشانی کرده ، پیوند ایجاد کنند. این پیوند که از همپوشانی اوربیتالهای p کربن ایجاد میشود، از نظر شکل و انرژی ، با پیوند σ متفاوت میباشد و به پیوند π موسوم است که از دو قسمت تشکیل شده است.
یک ابرالکترونی در بالای سطح مولکول و ابر الکترونی دیگر ، در پایین سطح قرار میگیرد. وقتی این ساختمان میتواند انجام شود که تمام اتمهای شرکت کننده در ساختمان اتیلن در یک سطح قرار گیرند. پس مولکول اتیلن لازم است یک مولکول مسطح باشد. مسطح بودن مولکول اتیلن بوسیله روشهای طیف سنجی و پراش الکترونی مورد تایید قرار گرفته است.
پروپن
پروپن به فرمول C3H6 ، CH3-CH=CH2 ، دومین عضو خانواده آلکنها میباشد که سه اتم کربن با 6 اتم هیدروژن به هم متصل شدهاند.
بوتن
بوتن به فرمول C4H8 عضو بعدی این خانوده است که برای آن ، چند نوع آرایش میتوان در نظر گرفت که در آنها ، چهار اتم کربن با هشت اتم هیدروژن طوری قرار بگیرند که قانون اکتت رعایت شده باشد. بوتن به ظاهر دارای سه ایزومر میباشد، ولی مطالعات تجربی نشان داده است که برای آلکنی به فرمول C4H8 چهار ساختمان فیزیکی کاملا متفاوت وجود دارد.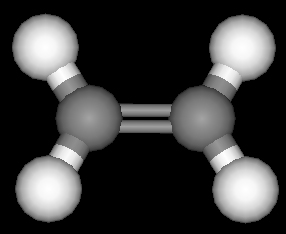
روش آیوپاک برای نامگذاری آلکنها
در روش آیوپاک ، نامگذاری آلکنها با رعایت نکات زیر انجام میشود:
بلندترین زنجیری را که پیوند دوگانه کربن- کربن در آن قرار گرفته باشد، انتخاب میکنیم.
زنجیر اصلی را به نحوی شماره گذاری میکنیم که اولین کربن روی پیوند دوگانه ، کوچکترین شماره را به خود بگیرد. (این روش تنها در مورد مشتقات کربن و هیدروژن صادق است. در نامگذاری الکل های اتیلنی و اسیدها و استرهای اتیلنی و برخی مشتقات دیگر ، اولویت با عوامل الکل ، اسید و استر میباشد.)
شماره کربنهایی را که استخلافها در روی آنها قرار گرفتهاند، مشخص میکنیم.
اگر قرار باشد ایزومرهای هندسی ماده مشخص گردد، در اول نام ماده از پیشوند cis و trans یا E و Z استفاده میکنیم.
خواص فیزیکی آلکنها
بطور کلی ، خواص فیزیکی آلکنها مشابه آلکانهاست. آلکنها در حلالهای غیرقطبی مانند اتر ، کلروفرم و دیکلرو متان محلول ولی در آب نامحلول میباشند و سبکتر از آب نیز میباشند. نقطه جوش آلکنها با افزایش تعداد کربنها افزایش مییابد. بجز آلکنهای کوچک ، نقطه جوش آلکنها به ازای افزایش یک اتم کربن بین 20 تا 30 درجه سانتیگراد افزایش مییابد. همانند آلکانها ، شاخهدار شدن آلکنها موجب کاهش نقطه جوش میشود.
آلکنها اندکی قطبیتر از آلکانها هستند این قطبیت اندک در اثر خصلت الکترون دهی و الکترون گیری گروهها ایجاد میگردد. وقتی روی آلکنها ، گروههای القایی با قدرت بیشتر قرار میگیرد، ممان دو قطبی اندکی افزایش مییابد.
 گزارشکار آزمایشگاه شیمی صنعتی
گزارشکار آزمایشگاه شیمی صنعتی گزارش کار شیمی عمومی2 شناسایی و جداسازی کاتیون های گروه چهارم
گزارش کار شیمی عمومی2 شناسایی و جداسازی کاتیون های گروه چهارم نام آزمایش : تهیه پتاسیم تري اگزالاتو کرومات (III) تري هيدرات
نام آزمایش : تهیه پتاسیم تري اگزالاتو کرومات (III) تري هيدرات آزمایشگاه بیوشیمی1
آزمایشگاه بیوشیمی1 گزارشکار تعیین درصد خلوص مواد شیمیایی
گزارشکار تعیین درصد خلوص مواد شیمیایی دانلود جزوه شیمی عمومی 1
دانلود جزوه شیمی عمومی 1 اتیلن دی آمین تترا استیک اسید (Ethylenediaminetetraacetic acid) (EDTA)
اتیلن دی آمین تترا استیک اسید (Ethylenediaminetetraacetic acid) (EDTA) گزارشکار آزمایشگاه فیزیولوژی جانوری
گزارشکار آزمایشگاه فیزیولوژی جانوری محلول های بافر یا تامپون
محلول های بافر یا تامپون متیل اورانژ چیست و چگونه تشکیل می شود؟
متیل اورانژ چیست و چگونه تشکیل می شود؟ شمع در شمعدان خود به خود روشن ميشود
شمع در شمعدان خود به خود روشن ميشود ۲۰ قسمت از بدن که احتیاجی به آن نداریم
۲۰ قسمت از بدن که احتیاجی به آن نداریم آزمایش های شیمی
آزمایش های شیمی گزارش کار شیمی معدنی: تهيه پرمنگنات پتاسيم از سنگ معدن پيرولوزيت و بررسي خواص منگنز و تعيين درجه خلو
گزارش کار شیمی معدنی: تهيه پرمنگنات پتاسيم از سنگ معدن پيرولوزيت و بررسي خواص منگنز و تعيين درجه خلو دانلود کتابچه آموزش نرم افزار Chem office
دانلود کتابچه آموزش نرم افزار Chem office شیمی معدنی (Inorganic Chemistry) تالیف جیمز هاوس (James E. House)
شیمی معدنی (Inorganic Chemistry) تالیف جیمز هاوس (James E. House) دانلود نمونه سوالات دروس عمومی نیمسال دوم 89-88
دانلود نمونه سوالات دروس عمومی نیمسال دوم 89-88 مقاله ایمنی و کمکهای اولیه در آزمایشگاه شیمی
مقاله ایمنی و کمکهای اولیه در آزمایشگاه شیمی رشد آموزش شیمی شماره 103. زمستان 91
رشد آموزش شیمی شماره 103. زمستان 91 نرم افزار برای رسم ۳ بعدی ترکیبات و اتم ها
نرم افزار برای رسم ۳ بعدی ترکیبات و اتم ها